Administración de Drogas y Alimentos de los Estados Unidos (FDA) recién aprobado un nuevo tratamiento revolucionario para la fibrosis quística, y es el primer tratamiento desarrollado para la enfermedad en décadas.
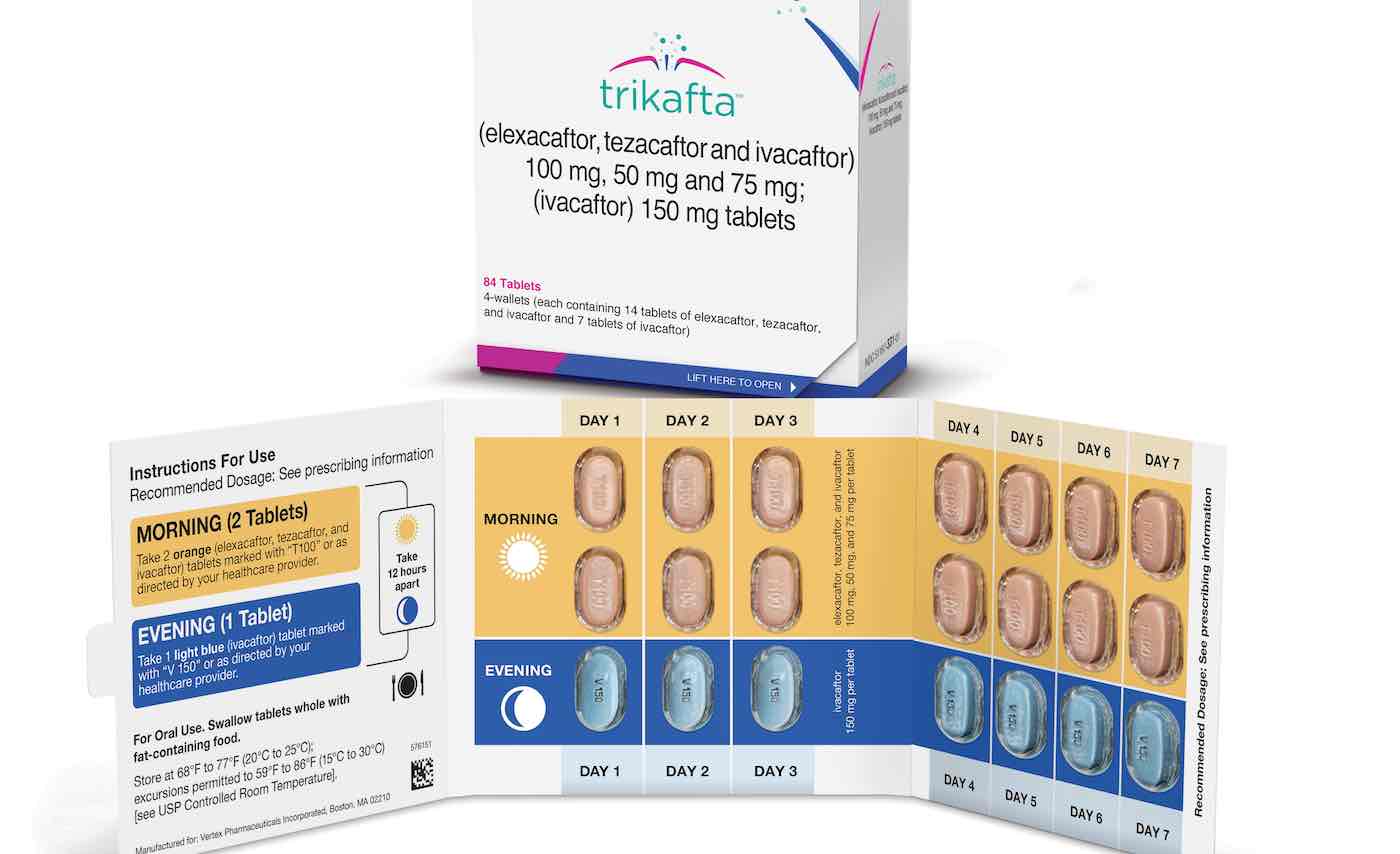
El fármaco Trikafta recientemente aprobado, que fue desarrollado por Vertex Pharmaceuticals, se puede usar para tratar pacientes con fibrosis quística de 12 años de edad y mayores que tienen al menos una mutación F508del en el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR).
Aunque hay alrededor de 2000 mutaciones conocidas del gen CFTR, la mutación más común es la mutación F508del, y Trikafta es el primer tratamiento aprobado que es eficaz para estos pacientes con fibrosis quística, que representan alrededor del 90 % de las personas con la enfermedad.
La fibrosis quística, una enfermedad rara, progresiva y potencialmente mortal, da como resultado la formación de una mucosidad espesa que se acumula en los pulmones, el tracto digestivo y otras partes del cuerpo. Esto conduce a graves problemas respiratorios y digestivos, así como a otras complicaciones como infecciones y diabetes. La fibrosis quística es causada por una proteína defectuosa que resulta de mutaciones en el gen CFTR.
MÁS: El primer fármaco para el Alzheimer está a la espera de la aprobación de la FDA después de que los pacientes experimentaran una marcada mejoría cognitiva
Trikafta es una combinación de tres medicamentos que se dirigen a la proteína CFTR defectuosa. Ayuda a que la proteína producida por la mutación del gen CFTR funcione de manera más eficiente. Las terapias actualmente disponibles que se dirigen a la proteína defectuosa son opciones de tratamiento para algunos, pero muchos pacientes tienen mutaciones que, hasta el momento, no son elegibles para el tratamiento.
La eficacia de Trikafta en pacientes mayores de 12 años con fibrosis quística se ha demostrado en dos estudios. El primer estudio fue un estudio aleatorizado, doble ciego, controlado con placebo de 24 semanas en 403 pacientes, mientras que el segundo estudio fue un estudio aleatorizado, doble ciego, con control activo de cuatro semanas en 107 pacientes que tenían dos F508dels. mutaciones
En cada estudio, el análisis primario observó aumentos en el volumen espiratorio forzado previsto en un segundo, conocido como ppFEV1, que es un marcador establecido de la progresión de la enfermedad pulmonar.
ÉCHALE UN VISTAZO: Tras años de investigación, una científica de Cambridge podría estar a punto de curar la esclerosis múltiple
Trikafta aumentó el ppFEV1 en ambos estudios. En el primer estudio, aumentó el ppFEV1 medio en un 13,8 % desde el inicio en comparación con el placebo. En el segundo estudio, aumentó el ppFEV1 medio en un 10 % desde el inicio en comparación con tezacaftor/ivacaftor. En el primer estudio, el tratamiento con Trikafta también condujo a mejoras en el cloruro del sudor, la cantidad de exacerbaciones pulmonares (empeoramiento de los síntomas respiratorios y la función pulmonar) y el índice de masa corporal (relación peso-altura) en comparación con el placebo.
La Cystic Fibrosis Foundation (CFF), líder mundial en la búsqueda de una cura para la FQ, elogió la aprobación del tratamiento por parte de la FDA como «el mayor avance terapéutico en la historia de la FQ».
Cuando se formó la fundación en 1955, no había tratamientos disponibles para la enfermedad. Ahora presidente y director ejecutivo de CFF, Dr. Preston Campbell decir: “Nosotros en la Fundación FQ y muchos en la comunidad FQ hemos soñado con este hito durante décadas.
RELACIONADO: Después de que el 68 % de los pacientes se curaran del TEPT en los ensayos de fase 2, es posible que las clínicas pronto ofrezcan terapia con MDMA
«A lo largo de mis décadas como médico que atiende a personas con FQ, he esperado con ansias el día en que podamos transformar drásticamente el tratamiento de esta enfermedad. Estoy profundamente agradecido de decir que ha llegado el día”.
Un representante de Vertex KXAN dijo que el medicamento estará disponible comercialmente por alrededor de $311,000 al año, pero dice que confían en que las compañías de seguros estarán dispuestas a aliviar la carga financiera del tratamiento en función de los resultados de su investigación.
(RELOJ entrevista a continuación)
Asegúrese de compartir las buenas noticias con sus amigos en las redes sociales…